|
Von B. Grouber und W. Parmentier
Zusammenfassung: Die Theorie der komplexen
Koazervierung wird erörtert und der Einfluß verschiedener Gelatinesorten
auf den Trockenrückstand und auf die Ausbeute des Koazervates untersucht.
Die besten Resultate ergeben sich beim Gelatine/Gummi Arabicum-System dann,
wenn eine sauer aufgeschlossene, demineralisierte Gelatine aus Schweineschwarten
mit hoher Gallertfestigkeit und Viskosität eingesetzt wird. Weiterhin
werden zwei modifizierte Gelatinesorten vorgestellt und ihre Brauchbarkeit,
Koazervate zu bilden, aufgezeigt.
Summary: The theory of complex coacervation
is discussed and the influence of different types of gelatin on the loss
on drying and on the result of the coacervate examined. The best results
by the gelatin/accacia system will be given, if anacid treated, demineralized
pig skin gelatin with high gelly strength and viscosity is used. Furthermore,
modified types of gelatin are presented and their usefullness for forming
coacervates is shown.
I. - THEORIE DER KOAZERVIERUNG
1.1. Allgemeines
Im Jahre 1930 haben zwei holländische Chemiker,
Kruyt und Bungenberg de Jong, ein Phänomen entdeckt und beschrieben,
welches bei wässrigen, kolloidalen Lösungen zu beobachten ist:
wenn man einer kolloidalen Gelatinelösung massiv eine andere kolloidale
Lösung entgegengesetzter elektrischer Ladung - beispielsweise Gummi
Arabicum - zusetzt, kann man einen konzentrierten, makromolekularen Anteil
ausfällen. Setzt man aber die zweite Lösung vorsichtig zu, so ist
zu beobachten, daß sich kleine Tröpfchen bilden, die aus einem
Komplex Gelatine/Gummi arabicum bestehen, während die übrige Lösung
immer ärmer an Polymeren wird. Dieses Phänomen bezeichnet man als
komplexe Koazervierung (lateinisch co : zusammen, acervus : Anhäufung).
Daneben gibt es die einfache Koazervierung, bei der schon ein Kolloid allein
durch Veränderung bestimmter Parameter das Phänomen der Phasenseparation
zeigt.
Ursache für die Absonderung von Kolloiden
aus einer klaren Lösung ist jeweils die gleiche: stark hydratisierte
Kolloidmoleküle werden durch Änderung bestimmter Parameter in ihrem
Hydratationsgrad beeinflußt. Sie werden weniger löslich.
1.2. Komplexe Koazervierung
Bei der komplexen Koazervierung wird ausgenutzt,
daß manche in Wasser (oder jedem anderen polaren Lösungsmittel)
gelösten Kolloidmoleküle aufgrund der Dissoziation saurer oder
basischer Gruppen eine elektrische Ladung besitzen. Dies führt einmal
dazu, daß zwischen gleichsinnig geladenen Molekülen eine Abstoßung
besteht, andererseits werden aufgrund der Ladung mehr Wassermoleküle
gebunden als bei ungeladenen Kolloiden. Die Hydratisierbarkeit bei diesen
Kolloiden ist also entscheidend auch von der Ladung abhängig.
Fügt man in saurem Milieu zu Gelatine ein
zweites Kolloid mit entgegengesetzter Ladung hinzu, so ziehen sich die positiv
geladenen Gelatine- und die negativ geladenen (z.B. Gummi arabicum-) Moleküle
an. Dabei kompensieren sich die entgegengesetzten Ladungen mehr oder weniger
und es kommt damit zwangsläufig zu einer verminderten Anziehung der Wassermoleküle,
d.h. zu einer verminderten Hydratisierung. Es bilden sich kleine Tröpfchen
eines komplexen Kolloides, das aber noch stark wasserhaltig ist, da die vorher
stärker gebundenen Wassermoleküle bei schonendem Vorgehen noch
(schwach) gebunden bleiben. Allgemein ist für ein bestimmtes System (Temperatur,
Konzentration, pH) dann die geringste Hydratisierung vorhanden, wenn die
positiven und negativen Ladungsmengen sich entsprechen, so daß nach
außen hin keine Ladung vorhanden ist.
Wie bei anderen Elektrolyten ergibt sich die Ladung
eines hydrophilen Kolloids durch die Dissoziation seiner sauer oder basisch
wirkenden Gruppen. Dies sind normalerweise Carboxyl- bzw. Amino-Gruppen.
Die Ladungsmenge ist umso größer, je mehr Gruppen dissoziieren,
je stärker also der Dissoziationsgrad wird. Durch Anwendung des Massenwirkungsgesetzes
auf die elektrolytische Dissoziation läßt sich folgern, daß
umso mehr saure Gruppen dissoziiert sind, je basischer der pH der Lösung
gemacht wird. Je nach dem, wie leicht die Amino- und Säure-Gruppen Protonen
aufnehmen bzw. abgeben, d.h. dissoziieren, liegen bei stärker saurem
pH noch Carboxylgruppen bzw. bei stärker basischem pH noch Aminogruppen
nennenswert dissoziiert vor. Eine Kennzahl dafür ist die Dissoziationskonstante
bzw. der mit -1 multiplizierte Logarithmus davon, der pK-Wert. Ist der pH-Wert
einer Lösung gleich dem pK-Wert, so ist die Zahl der undissoziierten
Moleküle (bei idealer Verdünnung) gleich der Zahl der dissoziierten.
Bei hochmolekularen Verbindungen wie Kolloiden
ist es nicht so leicht möglich, pK-Werte anzugeben. Gelatine ist zudem
amphoter, da sowohl Amino- als auch Carboxylgruppen im Molekül vorhanden
sind. Bei den 17 in Gelatine vorkommenden Aminosäuren wurden pK-Werte
für die Säuregruppe gefunden, die zwischen 1,8 - 2,5 liegen. Für
die Aminogruppe wurden pK-Werte von 9,0 - 9,8 gemessen.
Zum Verständnis der Dissoziationsverhältnisse
bei amphoteren Molekülen sei eine Aminosäure betrachtet, die nur
eine Carboxyl- und eine Aminogruppe enthält. Ein Beispiel dafür
ist Glykokoll, das zu ca. 27% in Gelatine enthalten ist. Glykokoll hat einen
pK-Wert der Säuregruppe von 2,5 und der Aminogruppe von 9,5. Trägt
man den Verbrauch an HCl bzw. NaOH gegen den pH-Wert der Lösung auf,
ergibt sich für Glykokoll eine Titrationskurve, die in Abb. 1 wiedergegeben
ist.
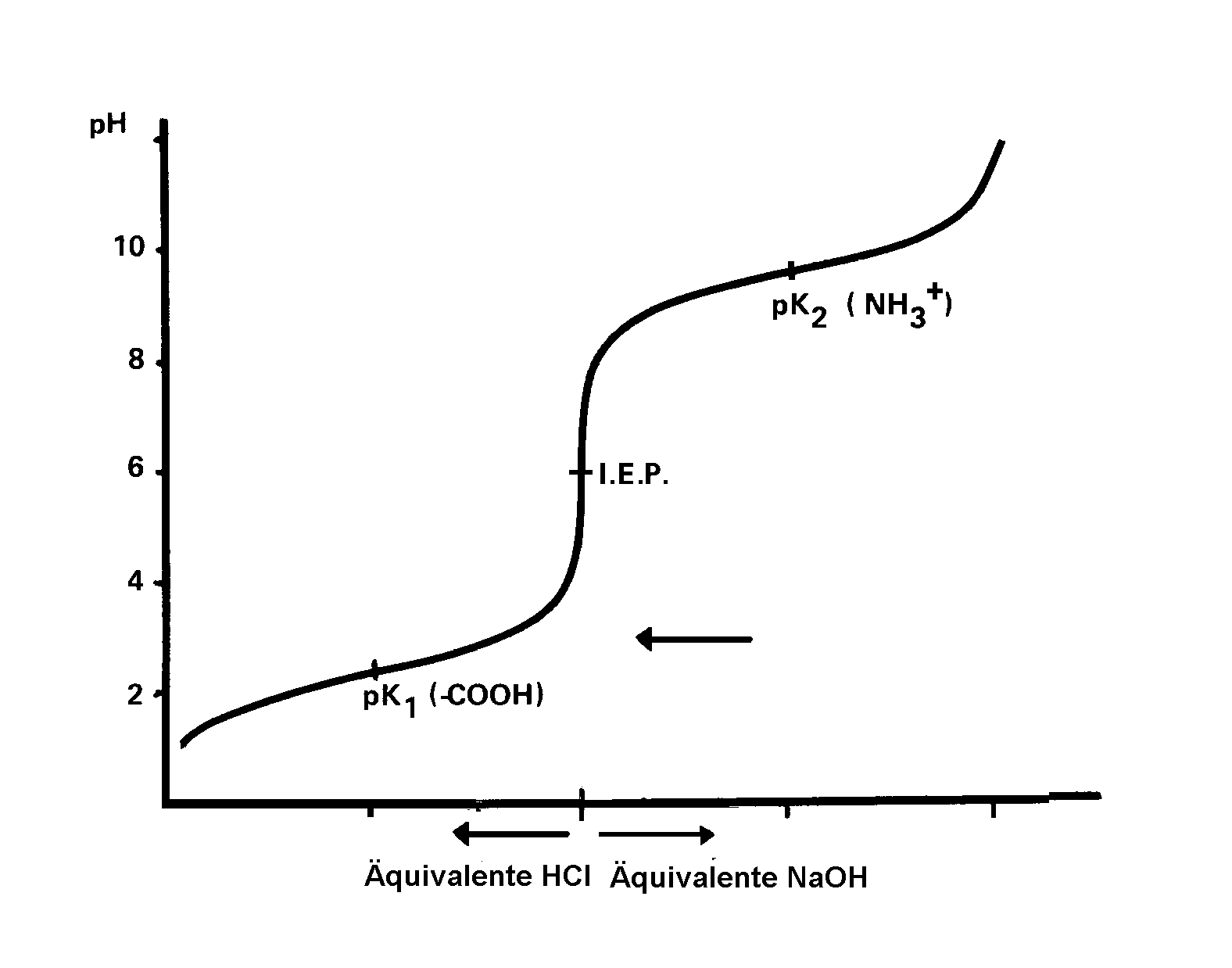
Abb. 1 : Titrationskurve von Glykokoll
An dem mit I.E.P. bezeichneten Punkt, dem isoelektrischen
Punkt, ist die positive Ladung von Glykokoll (durch die Protonierung der
NH2-Gruppe hervorgerufen) gleich der negativen Ladung (durch die Dissoziation
der COOH-Gruppe). Das Aminosäuremolekül reagiert also neutral,
in einem elektrischen Feld erfolgt bei einem pH = I.E.P. keine Wanderung
der Ionen.
Da Gelatine aus peptidisch zu langen Ketten gebundenen
Aminosäuren besteht, besitzt auch Gelatine einen isoelektrischen Punkt.
Der vollständige Ladungsausgleich hat bei Gelatine zur Folge, daß
die Gelatinemoleküle die dichteste Packung einnehmen können, da
die Abstoßungskräfte (der gleichsinnig geladenen Gruppen) dann
den geringsten Wert besitzen. Durch das Fehlen einer Ladung nach außen
werden auch die Wassermoleküle weniger stark gebunden. Dies beides führt
dazu, daß Gelatine am I.E.P. die geringste Löslichkeit besitzt.
Man kann dies nachweisen (diese Methode wird zur Bestimmung des I.E.P. von
Gelatine benutzt), indem man von der gleichen Gelatine Lösungen mit
aufsteigendem pH herstellt und abkühlen läßt. Der pH, bei
dem die Trübung, d.h. die Unlöslichkeit am größten ist,
entspricht dem I.E.P.
Da neben dem Ladungsausgleich auch die Ladungsmenge
für die Hydratisierung entscheidend ist, bildet sich ein um so stärkerer
Komplex, je größer die positive und negative Ladungsmenge ist,
je dissoziierter also das Kolloid und das Gegenkolloid in der Lösung
zuerst vorliegt. Bei Gelatine ergibt sich eine immer stärker positive
Ladung, je niedriger der pH der Lösung gemacht wird, da immer mehr NH2-Gruppen
dissoziieren. Die Abhängigkeit des jeweiligen Dissoziationsgrades vom
pH-Wert sollte bei Gelatine deshalb ähnlich sein wie bei den Aminosäuren
(s. Abb 1.). Praktisch konnte bis jetzt aber eine solche Kurve nicht ermittelt
werden. Man macht sich zunutze, daß die dissoziierten Moleküle
Ladungsträger sind und deshalb in einem elektrischen Feld wandern. Je
stärker die Ladung ist, um so größer ist die Wanderungsgeschwindigkeit
der Moleküle. In den pH-Bereichen, in denen sich die größten
Änderungen der Wanderungsgeschwindigkeit ergeben, müßten
deshalb die mittleren pK-Werte der Säure- und Basegruppen des Kolloides
liegen. Eine genauere Bestimmung ist jedoch nicht möglich, da die so
(unter Berücksichtigung der Viskosität usw.) ermittelte Ladung,
das sogenannte Zeta-Potential, nicht allein von den dissoziierten Molekülen,
sondern auch z.B. von der Stärke der Hydratation und dem Anteil der
Fremdionen abhängt.
Auch weichen die gefundenen isoelektrischen Punkte
von verschiedenen Gelatinequalitäten deutlich von der Theorie ab. Entsprechend
den oben erwähnten pK-Werten der in Gelatine vorkommenden Aminosäuren
müßte der I.E.P. von Gelatine entsprechend der Gleichung
pK1 + pK2
------------------- = I.E.P. (Gleichung 1)
2
bei Werten zwischen 5,4 - 6,2 liegen. Dies ist
aber nur selten der Fall. Die Werte, die man findet, hängen stark von
der Herstellungsart der Gelatine ab. Die am stärksten durch die Herstellung
beanspruchte alkalisch aufgeschlossene Knochengelatine hat einen I.E.P. um
5,O. Sauer aufgeschlossene Knochengelatine weist Werte des I.E.P. zwischen
6 und 7,5 auf. Sauer aufgeschlossene Schweineschwartegelatine schließlich
besitzt einen I.E.P. zwischen 8 und 9. Diese Abweichungen vom theoretischen
Wert des I.E.P. dürften ihre Erklärung darin haben, daß abhängig
von der Herstellung eine unterschiedliche Sekundär- und Tertiärstruktur
der Gelatine resultiert, die dazu führt, daß NH2- und COOH-Gruppen
unterschiedlich ionisierbar sind. Alle Qualitäten besitzen nämlich
praktisch dieselbe Aminosäurezusammensetzung, sodaß ein unterschiedlicher
Gehalt an sauren Aminosäuren (Asparaginsäure, Glutaminsäure)
und basischen Aminosäuren (Arginin, Lysin, Histidin) nicht der Grund
sein können.
Da es bei der komplexen Koazervation mit Gelatine
auf einen hohen Gehalt an ionisierbaren NH2-Gruppen ankommt, wird der sauer
aufgeschlossenen Schweineschwartengelatine meist der Vorzug gegeben, d.h.
also den Gelatinen mit hohem I.E.P.
Für die negativ geladenen Gegenkolloide ergibt
sich eine Abhängigkeit des Dissoziationsgrades vom pH-Wert, wie sie
für Säuren allgemein gelten. Je saurer die Lösung wird, um
so weniger COOH-Gruppen werden dissoziiert vorliegen und bei dem pH-Wert,
der dem mittleren pK-Wert der dissoziierten Gruppe des Gegenkolloides entspricht,
wird sich auch die stärkste Änderung des Dissoziationsgrades und
damit der Ladung mit dem pH ergeben.
II. - KOAZERVATION DURCH pH-VERSCHIEBUNG
2.1 Ermittlung des optimalen Koazervierungs-pH
Um den pH-Wert der Polymeren-Lösung zu finden,
der die bestmögliche komplexe Koazervation gewährleistet, geht
man am besten von einer stark verdünnten 1:1 Mischung von Gelatine und
Gegenkolloid aus und senkt dann langsam den pH dieser Lösung. Eine starke
Verdünnung ist notwendig, weil nach dem Ostwaldschen Verdünnungsgesetz
die Dissoziation nur bei starker Verdünnung maximal ist. Während
der pH-Absenkung kann man die Komplexbildung mit einem Trübungsmesser
verfolgen. Normalerweise nimmt die Opaleszens bis zu einem bestimmten pH-Wert
zu und dann wieder ab (s. auch Abb. 5 und 6). Dieser Verlauf läßt
sich damit erklären, daß durch die Absenkung des pH immer mehr
NH2-Gruppen der Gelatine dissoziieren und mit den vorhandenen COOH-Gruppen
des Gegenkolloides reagieren. Beim Opaleszensoptimum ist dann, wie schon erwähnt,
die gleiche positive und negative Ladung vorhanden. Geht man unter diesen
pH-Wert, nimmt die Dissoziation der Gelatine-Aminogruppen und damit die positive
Ladung zwar weiter zu, der Anteil der dissoziierten COOH-Gruppen des Gegenkolloides
verringert sich dagegen. Da der gebildete Komplex nur aufgrund des Ladungausgleiches
bestehen bleibt, geht bei einem Ungleichgewicht ein entsprechender Anteil
wieder in Lösung. Man kann deshalb durch weitere pH-Absenkung den Komplex
wieder ganz in Lösung bringen bzw. durch Anhebung wiederherstellen.
2.2. Ermittlung des notwendigen Kolloidverhältnisses
Zur Bestimmung des Gegenkolloidanteils, der notwendig
ist, eine bestimmte Menge Gelatine zu koazervieren, kann man sich der gleichen
Meßmethode bedienen. Man stellt die verdünnte Gelatinelösung
auf das gefundene Koazervierungs-pH-Optimum ein und tropft langsam eine verdünnte
Lösung des Gegenkolloids zu. Die Zunahme der Trübung nähert
sich asymptotisch dabei einem Grenzwert. Die Menge des Gegenkolloides, die
notwendig ist, um den Grenzwert der Opaleszens zu erreichen, ist zur Koazervierung
der vorgelegten Gelatinemenge notwendig. Bei dem Gelatine/Gummi arabicum System
beträgt das Verhältnis praktisch 1:1. Setzt man Carboxylmethylcellulose
ein, kann schon 1 Teil CMC genügen, um 5 Teile Gelatine zu koazervieren.
Da man aus wirtschaftlichen Gründen bei der
Mikroverkapselung nicht mit idealen Verdünnungen arbeiten kann, können
die nach den beiden beschriebenen Verfahren gewonnenen Werte bei höheren
Konzentrationen gewisse Korrekturen notwendig machen. Der Anteil des eingesetzten
Polymers, das koazerviert, sollte bei einem wirtschaftlichen Verfahren nicht
wesentlich unter 80 % liegen. Wird dieser Wert nicht erreicht, ist von einer
entsprechend verdünnteren Lösung auszugehen. Andererseits kann
ein Versuch mit höheren Kolloidkonzentrationen nützlich sein, wenn
man Werte erhalten hat, die darüber lagen. Die Kolloidkonzentration liegt
normalerweise zwischen 2-15 %.
Eine erhöhte Kolloidkonzentration ist vor
allem dann möglich, wenn man dem System kleinere Mengen eines stark
negativ geladenen Polymers (z.B. das Mischpolymerisat von Acrylsäure
und Methacrylsäure) zusetzt. Bei tiefem pH zugesetzt liefert dies Polymer
noch ausreichend negative Ladung, um mit weiteren Gelatinemolekülen
zu reagieren. Es handelt sich dabei vor allem um den hochmolekularen Gelatineanteil,
denn je längerkettig das Molekül ist, um so geringer ist die Dissoziationskonstante
und damit die Ladung der endständigen Aminogruppe.
2.2. Durchführung einer Mikroverkapselung
durch komplexe Koazervation mit Gelatine
a) Herstellung der Gelatinelösung
- durch die klassische Methode: Quellung
im kalten Wasser und anschließendes Lösen im Wasserbad bei
60°C.
b) Herstellung der Gummi Arabicum Lösung
- entsprechend der unterschiedlichen Patente
können die Konzentrationen zwischen 6 und 25 % schwanken. Hinsichtlich
des Verhältnisses von Gelatine zu Gummi Arabicum kann man sagen,
daß eine Koazervation nicht stattfindet, wenn weniger als 19 %
oder mehr als 81 % Gummi Arabicum eingesetzt werden. Nach Bungenberg
de Jong soll der optimale Anteil bei 59 % Gummi Arabicum und damit
41 % Gelatine liegen. Aufgrund der einfacheren Dosierung und weil die Ergebnisse
praktisch identisch sind, werden normalerweise aber 50 % jedes dieser
Polymere eingesetzt.
c) Herstellung der Emulsion (falls es sich
um eine Flüssigkeit handelt) oder der Suspension (bei Feststoffen)
- durch Zusatz des zu verkapselnden Produktes
zur Gummi Arabicum Lösung. Die Gelatinelösung wird dann unter Rühren
zugesetzt.
d) langsame Absenkung des pH, um die Koazervation
und Gelierung des Koazervates herbeizuführen.
- durch Zusatz von Essig- oder Salzsäure
e) Härtung der Kapseln mit Form-
bzw. Glutaraldehyd, Abtrennung derselben durch Filtration oder Zentrifugation
und Trocknung und Siebung der Kapseln.
Das in Schema 1 dargestellte Prinzip illustriert
die Aufeinanderfolge der notwendigen Schritte am Beispiel der Verkapselung
von Diphenylchlorid. Der Parameter, der hier variiert wird, ist die Konzenentration.
Man verdünnt mit Wasser. Die angegeben Mengen entsprechen jenen, die
im US-Patent 2.800.457 vom 23.7.1957 von Green und Schleichen (NCR) angegeben
worden sind.
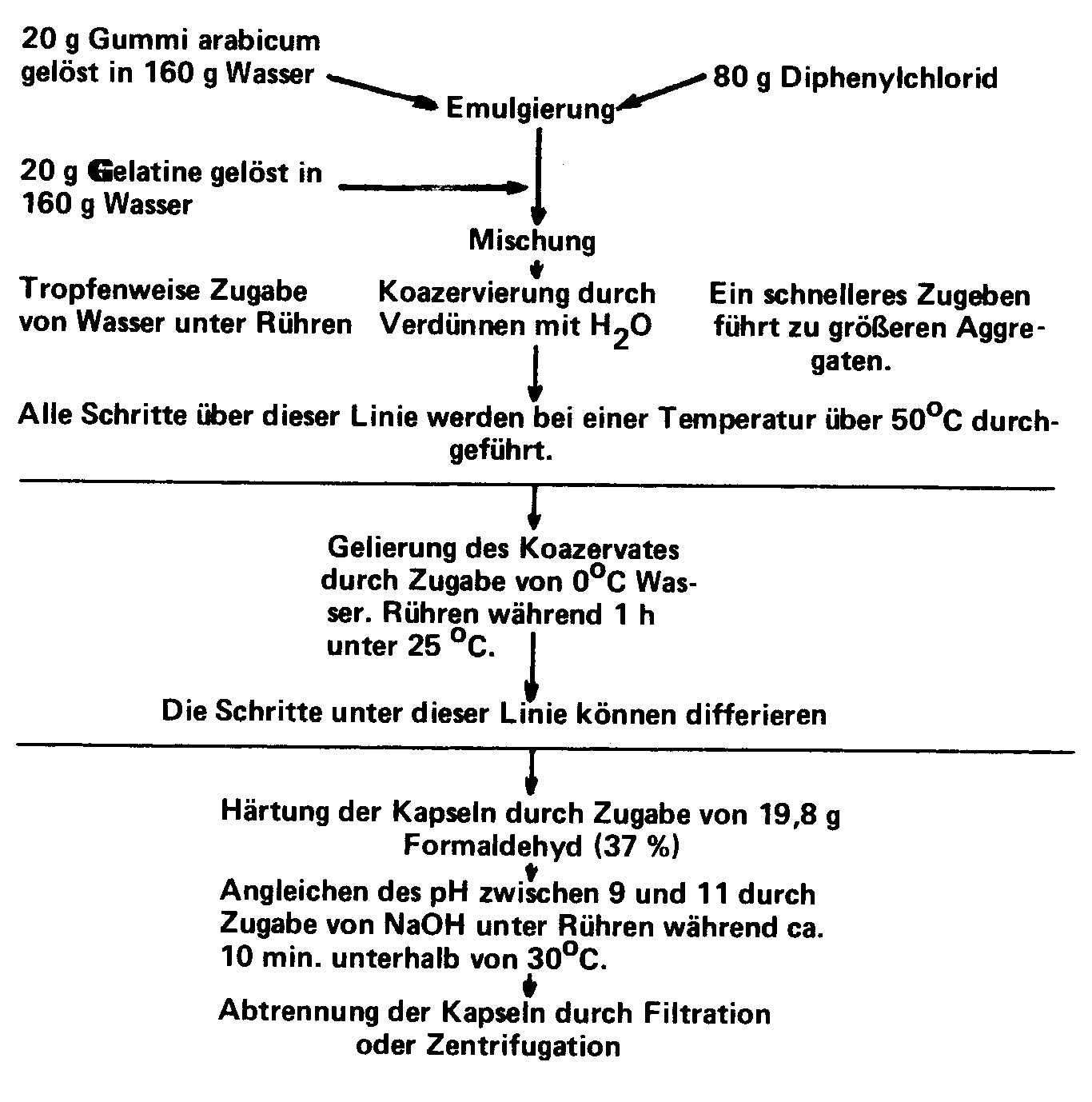
Schema eines Mikroverkapselungsprozesses durch
komplexe Koazervation.
III. UNTERSUCHUNG DES EINFLUSSES VERSCHIEDENER
GELATINESORTEN AUF DIE KOAZERVATION
3.1. Versuchsdurchführung
Um die Gelatinesorten zu testen, wurde das Gelatine/
Gummi arabicum-System im Verhältnis 50 : 50 gewählt, wie es in
dem Patent der NCR beschrieben ist. Einer Lösung mit 1,6 % Gummi arabicum
(20 g aufgelöst in 1.220 ml Wasser) mit einem eingestellten pH von 6,5
wurden 182 g von einer 11 %igen Gelatinelösung zugegeben. Die Mischung
wurde bei einem pH von 6,5 bei 55o C gehalten, bis sie vollständig
homogen war. Anschließend wurde unter ständigem Rühren fortschreitend
der pH gesenkt, indem man 1 N-Salzsäure langsam zufügte. Dadurch
wurde die Koazervierung hervorgerufen. Nachdem der Ansatz eine Stunde lang
bei 55o C gehalten wurde, ließ man ihn erkalten, um die
Gelierung des Kolloids zu erreichen.
3.2. Meßergebnisse und Diskussion
Zur Beurteilung des Ergebnisses der Koazervation
wurden zwei Größen herangezogen:
- Trockenrückstand des Koazervates
(je höher dieser ist, umso widerstandsfähiger sind die Kapseln
und umso leichter ist ihre Abtrennung und Trocknung).
- Ausbeute, die man als Prozentsatz
der eingesetzten Kolloidmenge zu der in der koazervierten Phase wiedergefundenen
ausdrückt.
In Abb. 2 sind die Kurven wiedergegeben, die
für die Abhängigkeit des Trockenrückstandes vom Koazervierungs-pH
gefunden wurden.
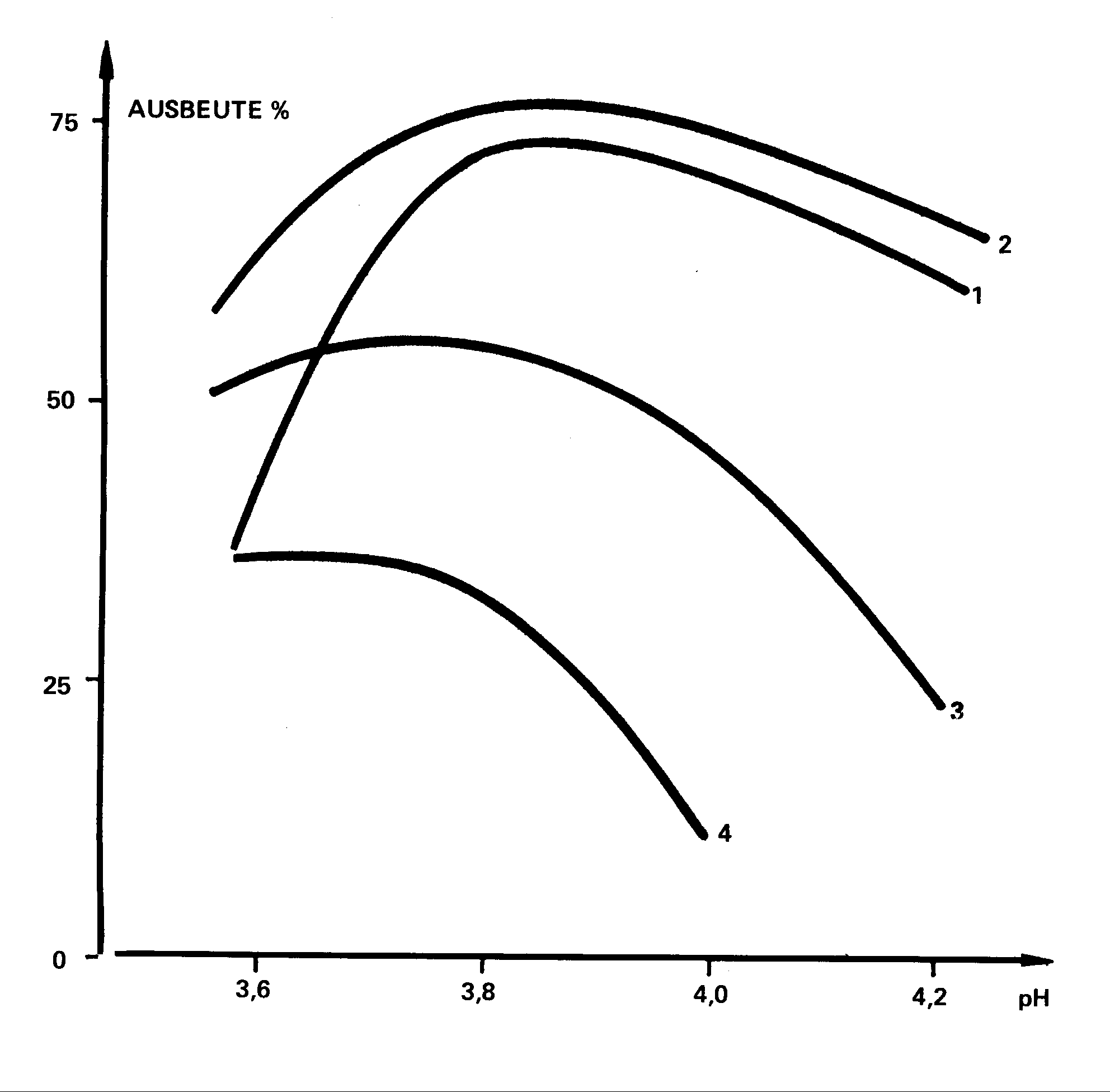
Abb. 2 : Abhängigkeit des Trockenrückstandes
des Koazervates von verschiedenen Gelatinesorten vom Koazervierungs-pH
Man erkennt, daß sich das Koazervierungsoptimum
beim Gelatine/Gummi arabicum-System bei einem pH von 3,8 befindet. Dies gilt
für gekälkte Gelatinesorten. Bei sauer aufgeschlossenen Schweineschwartengelatinen
ist das pH-Optimum etwas höher.
3.2.1. Einfluß der Gallertfestigkeit
Sowohl für alkalisch als auch für sauer
aufgeschlossene Gelatinequalitäten läßt sich feststellen,
daß der Anteil, der koazerviert, mit Abnahme der Gallertfestigkeit
geringer wird.
In Abb. 3 sind die Ergebnisse dargestellt, die
mit vier Knochengelatinebouillons aus der Auskochung ein und desselben gekälkten
Osseins nacheinander erhalten wurden.
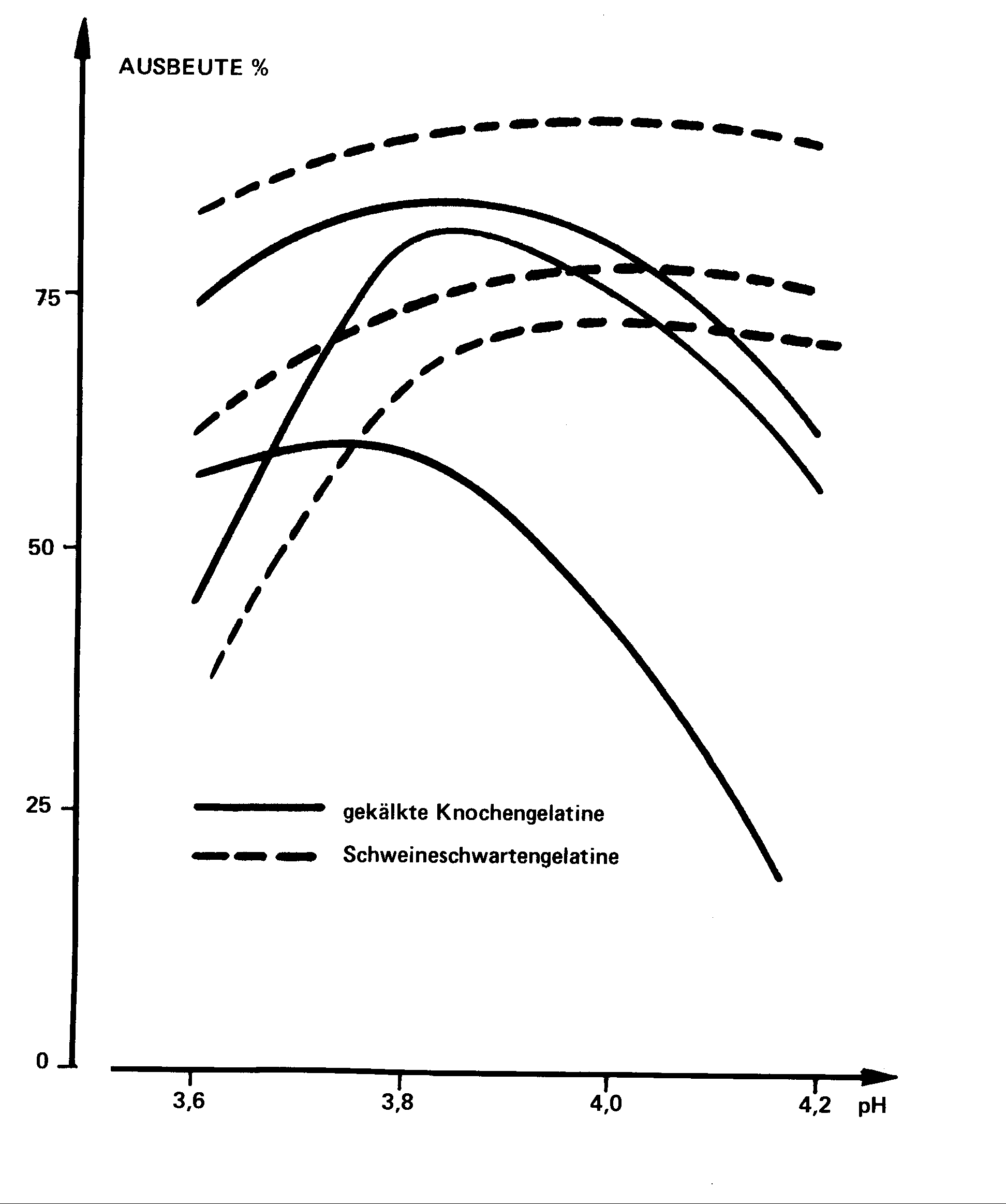
Abb. 3 : Abhängigkeit der Ausbeute von
der Gallertfestigkeit der eingesetzten Gelatine.
Die jeweilige Gelierkraft und die dementsprechenden Viskositäten sind
in Tabelle I angegeben.

Man kann aus den Ergebnissen einmal folgern, daß
eine hohe Gallertfestigkeit beim Gelatine/Gummi arabicum-System günstig
ist, um einen hohen Anteil koazervierten Materials zu bekommen. Andererseits
zeigt Tabelle I den starken Einfluß der Viskosität. Eine Gelatinequalität
mit geringerer Gallertfestigkeit aber höherer Viskosität kann zu
ähnlichen Ausbeuten führen.
3.2.2. Einfluß der Viskosität
Daß neben der Gelierkraft auch die Viskosität
der eingesetzten Gelatine (die ja direkt in Relation zum Molekulargewicht
steht) von großer Bedeutung ist, läßt sich verdeutlichen,
wenn man die Trockenrückstände der Koazervate und die (mit Gelatine
gleicher Eigenschaft erzielte) Ausbeute unter Berücksichtigung der Viskosität
vergleicht. Zwei Schweineschwartengelatinesorten beispielsweise erbrachten
Ergebnisse, wie sie in Tabelle II wiedergegeben sind.
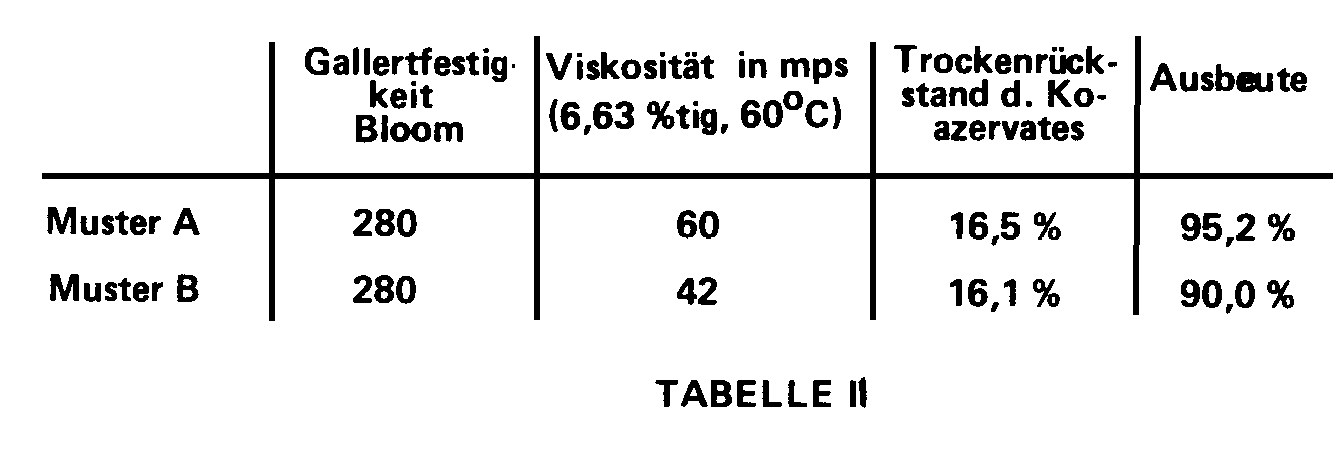
Die einzelnen Werte für das Koazervat sind
bei gleicher Gallertfestigkeit umso besser, je höher die Viskosität
der eingesetzten Gelatine ist.
3.2.3. Einfluß des Gelatineursprungs
Die Erfahrung zeigt, daß man mit Schweineschwarte-Gelatinequalitäten
Ergebnisse erzielt, die etwas besser sind als die mit Knochengelatinequalitäten.
Dessen ungeachtet ergab sich bei dieser Untersuchung, daß es notwendig
ist, daß die Schweineschwarte-Gelatinequalitäten eine hohe Gelierkraft
und eine hohe Viskosität aufweisen. Die beiden unteren Kurven entsprechen
hier Gelatinequalitäten von 240 - 250 Bloom mit niedriger Viskosität
(37 - 39 mps) .
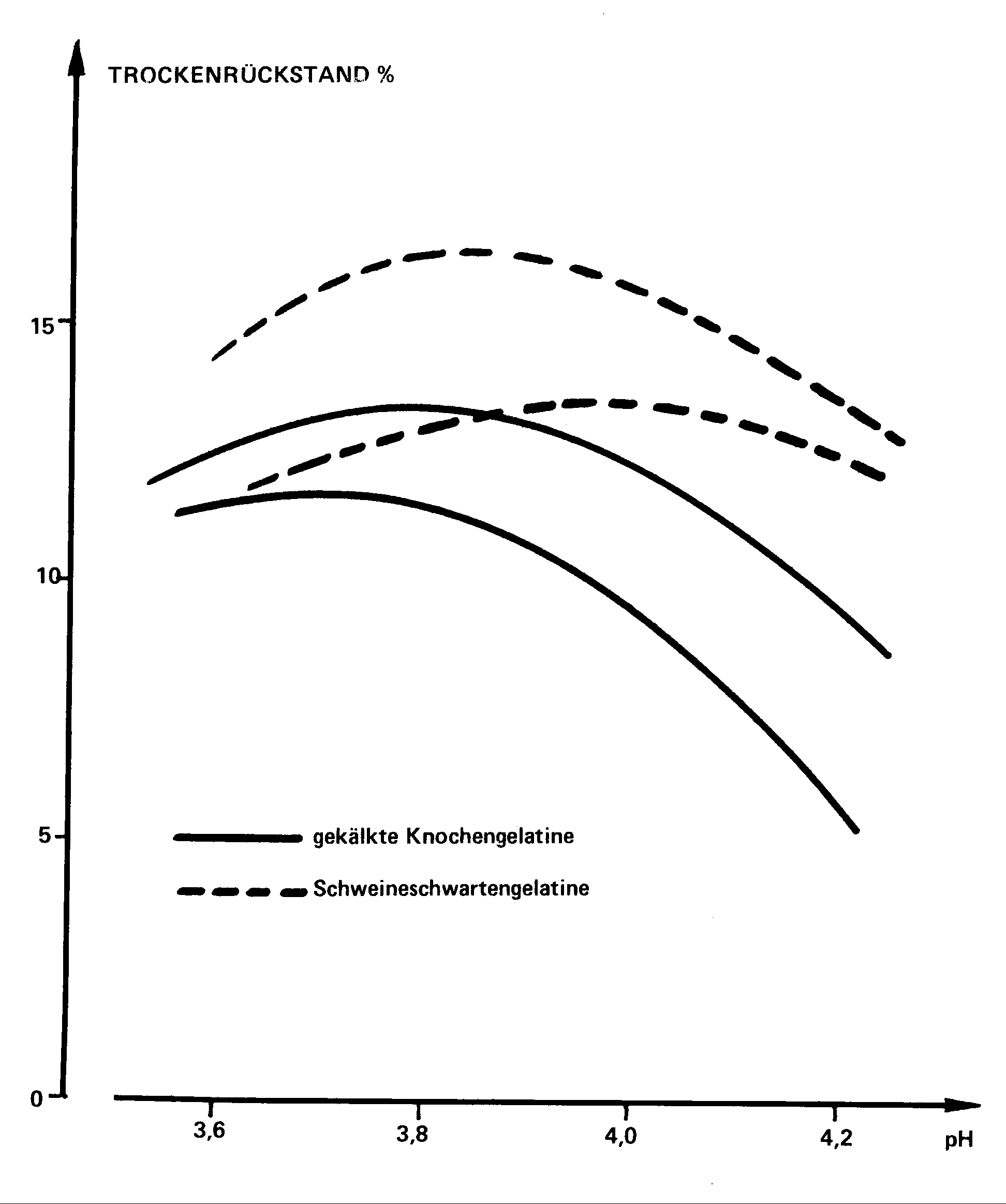
Abb. 4 : Einfluß des Gelatineursprungs
auf die Ausbeute
3.2.4. Einfluß der Demineralisierung
Um den Einfluß der Demineralisierung zu
studieren, wurde die Ausbeute der gleichen Gelatinesorte vor und nach der
Demineralisierung verglichen. Deutliche Unterschiede zeigen sich vor allem
bei der zweiten und dritten Bouillon einer gekälkten Knochengelatine
wie Tabelle III zeigt:
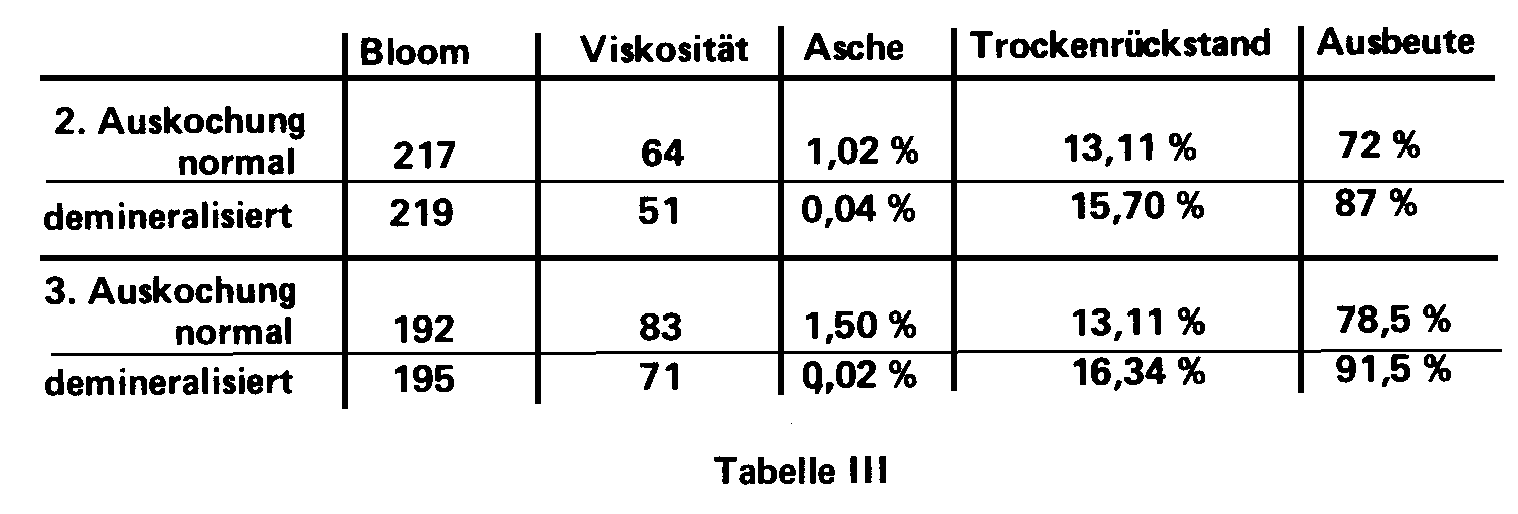
Man kann feststellen, daß bei niedrigem
Aschegehalt die Ergebnisse deutlich besser sind, obwohl die Viskosität
durch die Demineralisierung leicht vermindert wurde. Dabei ist vor allem
entscheidend, daß der Anteil der Erdalkali-Ionen, d.h. der Kationen,
möglichst gering ist. Negative Ionen wie Sulfat und Chlorid sind eher
tolerierbar. Kleine Mengen davon begünstigen u.U. sogar den Prozess.
3.2.5. Mitbeeinflussende Faktoren bei der
Herstellung von Mikrokapseln
Im Zusammenhang mit den oben erwähnten Resultaten
wurden verschiedene Verkapselungsversuche gemacht und aus den Untersuchungen
folgende Schlüsse gezogen:
Bei der Herstellung einer Emulsion des zu verkapselnden
Produktes hängt die Tröpfchengröße von folgenden Faktoren
ab:
- die Viskosität der Gelatinelösung,
d.h. dementsprechend von deren Temperatur und Konzentration. Je höher
die Viskosität ist, umso stabiler ist die erzielte Emulsion. Falls die
Viskosität zu gering ist, ist es nicht möglich, Mikrokapseln in
größerem Umfang zu erhalten.
- dem Rühren im Reaktionsgefäß:
die Geschwindigkeit muß ausreichend schnell sein, um das Produkt in
Suspension zu halten. Je höher sie ist, umso feiner sind die erzielten
Tröpfchen und umso regelmäßiger. Falls man das Produkt auf
einmal zugibt, erhält man Mikrokapseln mit größerem Durchmesser.
Andererseits kann es vorkommen, daß, wenn die Rührbewegungen zu
stark sind, die Wanddicke nicht regelmäßig ist (runde Tröpfchen
sind vor einer elipsenförmigen Kapselwand umgeben). Das Phänomen
kann auch bei festen Partikeln auftreten.
- der Dichte des zu verkapselnden Produktes.
Eine Emulsion mit einem Produkt höherer Dichte als der Gelatinelösung
läßt sich leichter realisieren. Bei geringer dichten Produkten,
die Verkapselt werden sollen, können die Tropfen an der Oberfläche
bleiben, und sich mit dem Schaum vermischen, so daß ihre Rückgewinnung
schwierig wird.
- der Dicke der Kapselwand. Die Dicke
der Kapselwand schwankt abhängig vom gewählten Koazervierungsverfahren
(Verdünnung, Senkung des pH's, usw.).
- Waschen der Mikrokapseln. Man muß
das Waschen mit sehr kaltem Wasser durchführen, um nicht die Wand anzulösen
und um zu verhindern, daß die Mikrokapseln zusammenkleben. Bis zur
Trocknung sollten sie deshalb auch im Kühlschrank gelagert werden.
3.2.6. Verwendung modifizierter Gelatinequalitäten
Unter Berücksichtigung der Struktur der Peptidketten
können folgende Kategorien modifizierter Gelatinequalitäten erhalten
werden:
a) durch Reaktion der Säuregruppen:
Beispiel: mit Äthylenoxyd : Hydroxyläthylester Gelatine
b) durch Reaktion der Aminogruppe :
Beispiel: mit Essigsäureanhydrid : Acetylierte Gelatine, mit Phthalsäureanhydrid
: Phthalierte Gelatine
c) durch Reaktion der beiden Gruppen gleichzeitig:
Beispiel: Phthalsäure Anhydrid und Äthylenoxyd
Für alle diese Möglichkeiten und die
zahlreichen Versuche, die durchgeführt wurden, sollen zwei bezeichnende
Beispiele angeführt werden, bei denen modifizierte Gelatinequalitäten
bei der Koazervation nennenswerte Ergebnisse gebracht haben. Bei beiden Gelatinequalitäten
wurde die Aminogruppe modifiziert.
Ein Versuch wurde vom US Patent 33 17.434 inspiriert,
das von der ARMOUR Gesellschaft angemeldet wurde. Bei diesem Verfahren ist
es notwendig, demineralisierte Gelatinequalitäten am isoelektrischen
Punkt zu verwenden, wobei eine Schweineschwartengelatine (isoelektrischer
Punkt 9,0) mit einer gekälkten Knochengelatine (isoelektrischer Punkt
5,05) koazerviert wird. Die Kenntnis dieses Verfahrens hat uns veranlaßt
zu versuchen, eine Mischung aus Schweineschwartengelatine und succinylierter
Gelatine zu koazervieren. Succinylierte Gelatine hat einen sehr niedrigen
isoelektrischen Punkt (4,0) und wird hergestellt durch Reaktion mit Bernsteinsäureanhydrid.
Zur Koazervierung wurde eine Mischung von 50 :
50 der beiden Gelatinequalitäten benutzt, die vorher einzeln in einer
geringen Konzentration (2 %) gelöst wurden. Unter diesen Bedingungen
betrug der Trockenrückstand des Koazervates 11,5 %. Um den koazervierten
Gelatineanteil zu erhöhen, wurde versucht, Isopropylalkohol der Mischung
zuzugeben, nachdem sich die Mikrokapseln schon gebildet hatten. Dabei ergab
sich eine Erhöhung des Trockenrückstandes auf 12,5 %. Es ist jedoch
zu berücksichtigen, daß durch den Zusatz von Alkohol das Risiko
der Diffusion des verkapselten Produktes durch die gelierte Wand größer
ist.
Weiterhin wurden Versuche mit N-Phenyl-Carbamyl-Gelatine
durchgeführt, die durch Umsetzen mit Phenylisocianat erhalten werden
kann. Diese Gelatine, die aus gekälkter, demineralisierter Knochengelatine
mit hoher Gelierkraft hergestellt wurde, besitzt die Eigenschaft, allein
zu koazervieren, d.h. ohne Zumischung von Gummi Arabicum oder anderen Kolloiden.
Dies läßt sich erreichen durch einfaches Senken des pH's. Dabei
erhält man einen sehr hohen Trockenrückstand, der höher ist
als bei den Schweineschwarten-Gelatinequalitäten, die bestmöglich
demineralisiert wurden. So wurde bei einer Gelatine mit 264 Bloom, 50 mps,
zu 98 % modifiziert, bei einem pH-Optimum von 4,3 ein Trockenrückstand
von 27 - 28 % erhalten, d.h. fast zweimal mehr als bei den Mischungen Schweineschwartengelatine
und Gummi Arabicum. 27 - 28 % Trockenrückstand entsprechen einem Polymeranteil
von 94 %, der koazerviert wurde.
Die Koazervierung dieser Gelatine dürfte
mit der Präsenz von aromatischen Kernen, die die Löslichkeit vermindern,
zusammenhängen. Da die Löslichkeit am isoelektrischen Punkt ein
Minimum hat, ist es möglich, eine maximale Koazervierung zu erzielen,
indem man fortschreitend den pH senkt und so diesen Wert erreicht.
Naturgemäß lassen sich mit N-Phenyl-Carbamyl-Gelatine
hergestellte Kapseln nicht gerben, weil die Aminogruppen blockiert sind und
somit nicht mehr mit den Aldehyden reagieren können. Deshalb wird diese
Gelatine hauptsächlich dann angewandt, wenn eine große Verträglichkeit
gegenüber Aromen, die oft aldehydische Gruppen tragen, gewünscht
wird.
Erwähnt sei, daß N-Phenyl-Carbamyl-Gelatine
nicht in Nahrungsmitteln eingesetzt werden kann, während die succinylierte
Gelatine von der Food und Drug Administration am 24.11.1968 für die
Mikroverkapselung von aromatischen Ölen erlaubt wurde.
REFERENCES
1 - Bungenberg de Jong, H. G. - Colloid Science
II, édité par H. R. Kruyt, pages 232-480 - Elsevier Publishing
Company Inc. New York 1949.
2 - Green et Schleicher - US Patent 2.800.457
- 23.7.57 (NCR)
3 - Saleh A. H. Khalil, J. R. Nixon et J.E. Carless
- J. Pharm. Pharmac. 1968 - 20. pages 215-225.
4 - Arthur Veis, S. et J. Cohen, C. Aranyi - US
Patent 3.317.434 - 2.5.67 (Armour)
|